沙粒病毒属于沙粒病毒科(Arenaviridae),是一类有囊膜的、分节段单股负链RNA病毒(Segmented Negative-Sense RNA virus, sNSV)。其中,目前所有已知能够引起人类疾病的沙粒病毒都属于哺乳动物沙粒病毒属(Mammarenavirus),其典型代表为拉沙病毒(Lassa virus, LASV)。LASV主要流行于非洲国家,每年可造成30,000-50,000人感染,约5000人死亡。目前针对大多数沙粒病毒感染尚没有特效药物与疫苗,相关疾病的治疗仍具有较大困难。
由于沙粒病毒的复制主要依赖于病毒自身合成的病毒聚合酶来完成,这一分子机器在所有的沙粒病毒中较为保守,而宿主细胞内基本不具备相同功能的蛋白。因此,靶向病毒聚合酶的药物便有希望能够获得良好的特异性。此外,在病毒生命周期中,沙粒病毒Z蛋白可以负调控聚合酶的活性以及促进病毒粒子组装。揭示沙粒病毒L蛋白的工作机制及其与Z蛋白相互作用的分子机制对于全面了解沙粒病毒的复制机制至关重要,也将为沙粒病毒感染相关疾病的预防和治疗提供新的指导方向。
根据沙粒病毒进化及其流行的地理学特征,哺乳动物沙粒病毒属又可分为旧大陆(Old World, OW)和新大陆(New World, NW)沙粒病毒群。为了系统地研究沙粒病毒的复制机制,中国科学院大学存济医学院(以下简称国科大医学院)施一教授团队前期分别解析了OW和NW沙粒病毒群中两个代表性病毒LASV和马秋波病毒(Machupo virus, MACV)聚合酶(L蛋白)的精细三维结构。通过结构分析和生化实验,他们发现沙粒病毒聚合酶的酶活中心处于天然开启的活性构象,并揭示了聚合酶与RNA的识别模式,初步阐明了聚合酶自身二聚化对其复制和转录活性的调控作用。这些发现为理解不同的sNSV在进化上的联系和差异提供了关键信息,也为后续靶向沙粒病毒聚合酶的药物设计提供了新的候选靶点(Nature,2020, 579: 615-619)。
最近,该团队进一步研究了沙粒病毒基质蛋白Z负调控聚合酶活性的分子机理。他们利用冷冻电镜技术分别解析了LASV和MACV L蛋白与其相应基质蛋白Z结合的复合物结构,以及L-Z二元复合体与3’-vRNA结合的三元复合体结构。结构显示,每对复合物中一个Z蛋白以单体形式结合在一个聚合酶上,且结合位点位于聚合酶的手掌结构域(Palm)外围,与RNA结合位点相距甚远,说明Z蛋白结合后并不影响聚合酶招募RNA模板,暗示着Z蛋白可能是通过别构效应来负调控聚合酶活性。
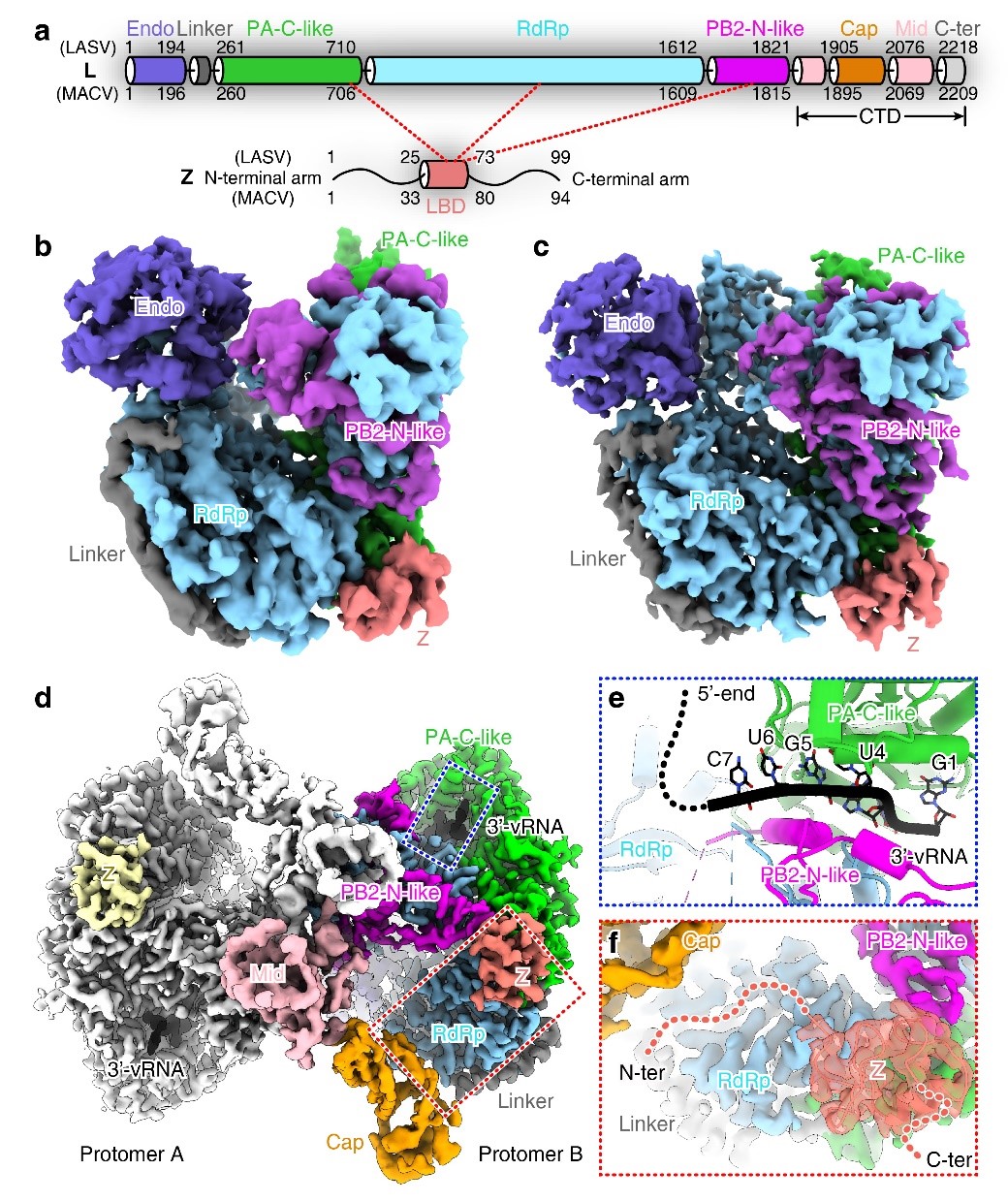
图1. LASV/MACV L-Z及其与vRNA复合体的整体结构
(a)L蛋白和Z蛋白的结构域划分示意图。(b)LASV L-Z复合物的冷冻电镜密度图。(c)MACV L-Z复合物的冷冻电镜密度图。(d)MACV-L-Z-vRNA复合物形成同源二聚体。(e)3’-vRNA结合位点的结构细节。(f)MACV-L-Z-vRNA复合物中Z蛋白结合位点的细节图。
通过对L-Z相互作用界面进行分析,研究人员发现Z蛋白结合在聚合酶中两个催化基序(motifs D and E)的远端,并处于多个结构域临近界面上,推测可能阻碍这两个催化元件在RNA合成过程中的构象变化,以使聚合酶失去催化活性。研究人员进一步利用氢氘交换质谱实验证明了这个假设。
此外,研究人员发现Z蛋白通过其中间结构域与L蛋白结合,其中一段高度保守的疏水性loop主导了与L蛋白的相互作用。由于此结合基序高度保守,他们还观察到LASV和MACV Z蛋白和L蛋白能够在体外呈现交叉抑制效果,这一现象表明OW和NW沙粒病毒Z蛋白调控L蛋白RNA合成的保守机制。以上研究发现为靶向聚合酶的广谱抗病毒药物设计提供了全新方向,提示可以通过抑制聚合酶保守性功能基序的构象变化来进行广谱性抑制剂开发。
图2:Z蛋白对聚合酶的别构调控作用
(a)流感病毒聚合酶在催化前状态下的结构,处于封闭构象(PDB ID: 6SZV)。(b)根据(a)中结构和新冠病毒聚合酶与核酸/药物复合物结构(PDB ID: 7CTT)预测的LASV L催化前构象结构模型。(c)LASV L结构中motif D和E的结构细节。(d)LASV L中motif D(红色)和E(黄色)的序列。质谱能够检测到的肽段用下划线表示。(e)Z蛋白及其突变体对LASV L氘代速率的影响。
此项工作系统地研究了沙粒病毒基质蛋白Z调控聚合酶活性的结构基础,有助于进一步理解沙粒病毒复制的分子机制及其负调控机理。这些发现为开发针对各种高致病性沙粒病毒的广谱抗病毒药物提供了重要候选靶点。相关成果日前已在Nature Microbiology杂志上作为七月封面文章提前在线发表,题为“Cryo-EM structures of Lassa and Machupo virus polymerases complexed with cognate regulatory Z proteins identify targets for antivirals.”
国科大医学院博士生徐欣、中国科学院微生物所副研究员彭如超和助理研究员彭齐为论文的共同第一作者,施一教授为通讯作者。此外,国科大医学院院长高福院士、中国科学院微生物所齐建勋研究员以及南方科技大学冷冻电镜中心主任王培毅教授等专家也提供了大力支持。该项目获得了中国科学院重点战略性先导科技专项(B类),国家科技重大专项,国家自然科学基金委优秀青年基金项目和青年科学基金项目,中国科学技术协会青年人才托举工程项目和中国科学院青年创新促进会等项目的经费支持。